每日甘肃网1月14日讯(新甘肃·每日甘肃网记者郭秀睿)今天下午,记者从省政府新闻办召开的新闻发布会上获悉,本着减程序、减流程、减资料、减时限的原则,甘肃省药品监督管理局从放宽市场准入、开辟绿色通道、取消现场核查、合并现场检查、精简办事材料、压缩审批时限、优化办事流程、容缺后补审批、优化审批服务、全程在线服务等十个方面,提出了23条具体的利企便民措施。便民举措的推出,也是为了进一步深化“放管服”改革、支持民营经济发展的一系列决策部署,聚焦保障药品安全目标,着力破除制约药品高质量发展活力和动力的障碍,最大限度利企便民、最大程度放活市场、最大力度服务发展。
23条便民举措:
一、放宽市场准入
(一)医疗机构应用传统工艺配制中药制剂由审批改为备案;医疗机构可委托符合条件的单位配制制剂。
(二)“药品广告异地备案”、“医疗机构放射性药品使用许可(一、二类)”审批,实施告知承诺制。
(三)省内药品生产企业通过兼并重组、联合发展等形式优化药品品种结构、盘活药品批准文号,涉及药品生产场地变更的,按省级审批事项办理。
(四)允许药品批发企业在全省范围内异地搬迁,符合迁入地准入条件即可办理变更事项。
(五)办理第二类医疗器械注册时,采信医疗器械注册申请人提交的由具备医疗器械检验资质的医疗器械检验机构出具的委托检验报告(包括预评价意见)。
(六)省药品监管局承担的所有许可和备案事项,全面取消市州监管部门初审。
二、开辟绿色通道
(七)符合《甘肃省第二类创新医疗器械特别审批程序》的医疗器械;符合产业政策鼓励发展的产品和项目;产品性能、技术处于国内领先水平,或填补省内该类产品空白;获得省级以上科技进步奖的许可事项纳入“创新通道”审批。对列入国家、省重点建设项目、优势品种(产品)的升级改造、临床急需、市场短缺的产品许可事项纳入“快捷通道”审批。重离子治癌装备注册上市进入国家审批快捷通道。
三、取消现场核查
(八)申请境内第二类医疗器械注册时,拟在取得《医疗器械注册证》后3个月内申报医疗器械生产许可的,将医疗器械生产许可检查提前纳入注册质量管理体系核查,申报医疗器械生产许可时,不再进行现场核查。
(九)通过企业落实主体责任,自查符合药品GMP、GSP以及医疗器械相关质量管理要求的,取消现场检查。
1、药品(含医疗机构制剂)关键生产(配制)设施等条件与现状发生变化事项;
2、核减中药饮片生产剂型(含品种)事项;
3、药品批发企业在同一县区内变更注册地址事项;
4、药品批发企业不变更仓库地址,仅改变仓库内部布局(阴凉库改为常温库或常温库改为阴凉库)以及原址增减阴凉库或常温库面积事项;
5、药品批发企业变更经营范围(不含增减特殊管理药品经营范围、冷链药品经营范围)事项;
6、原许可内容不发生变化,且许可期内无违法违规、无抽验不合格和不良事件情况的,申请第二、三类医疗器械生产许可延续事项、第二类医疗器械产品注册延续事项。
四、合并现场检查
(十)申请人拟同时办理多个事项时,可分项受理、合并检查。
1、中药饮片生产许可事项与药品生产质量管理规范认证事项;
2、药品生产企业迁址新建后,申请药品生产许可变更、药品注册申请变更、药品GMP认证事项;
3、药品生产企业原厂址就原生产范围改建、扩建以及新建生产车间申请药品生产许可变更和药品GMP认证事项;
4、医疗机构申请制剂许可证核发或变更事项与医疗机构制剂配制审批事项(不含委托配制制剂);
5、药品经营企业开办验收和首次GSP认证事项;
6、药品批发企业整体搬迁后的变更事项与《药品经营许可证》换证事项。
五、精简办事材料
(十一)全面清理精简证明材料,申请人按照公布的证明事项清单提供办事材料。
(十二)申请办理各类许可及备案事项,除需交回旧证换发新证以及需在副本记录的事项外,企业均无需提供原许可证及证明文件。
(十三)申请人办理行政审批业务时可以直接在审批系统“材料库”中调取需要提交的有效材料,不必重复上传。
(十四)申请人无需提供营业执照、医疗机构执业许可证、个人身份证明等材料,省药品监管局通过跨层次、跨部门数据共享,自行在网上获取核验相关信息。
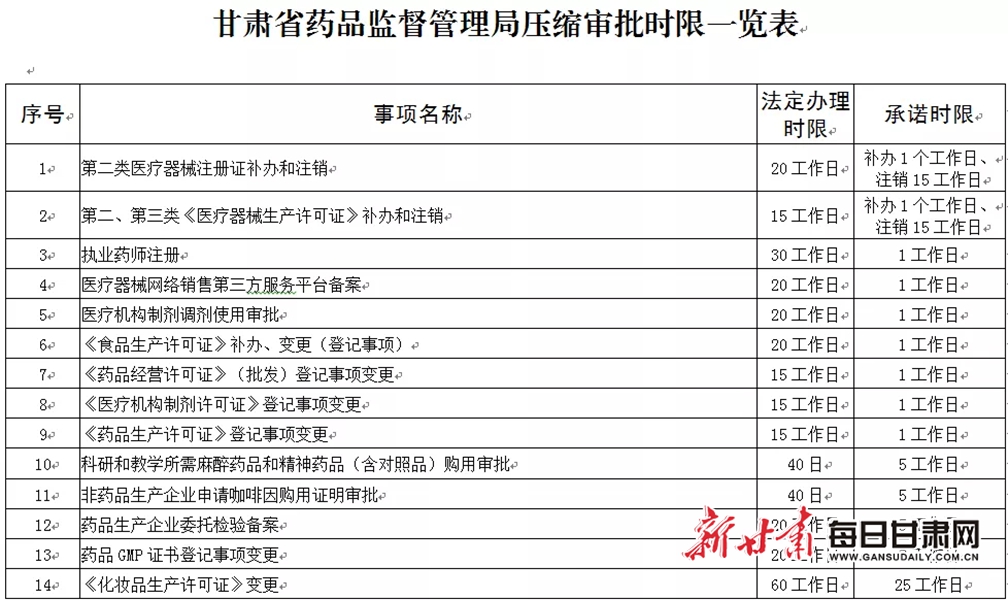
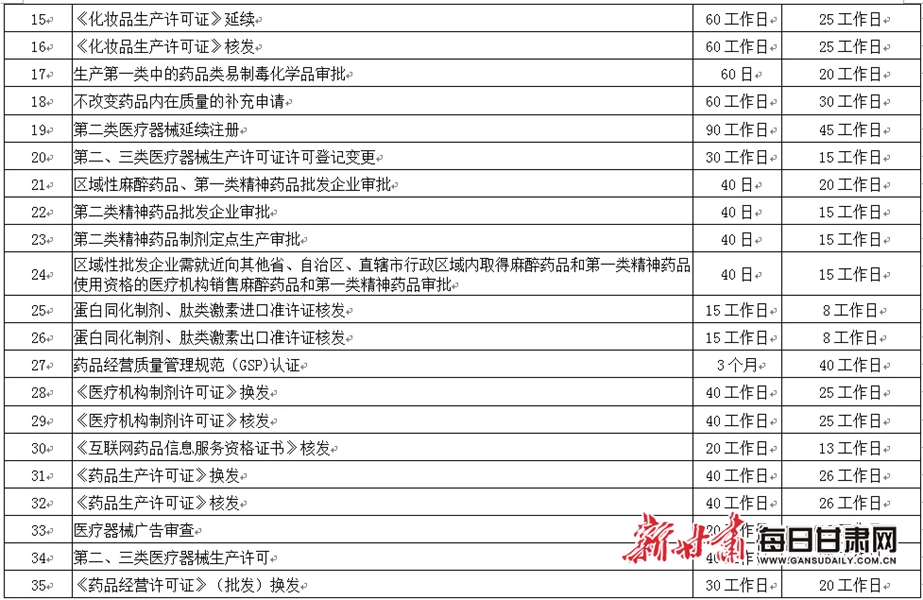
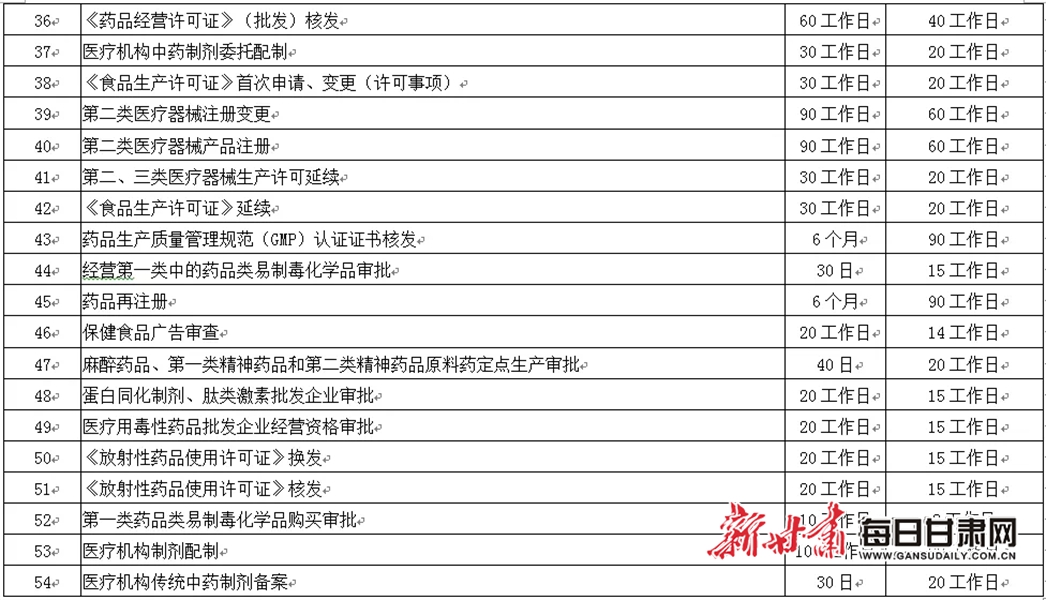
六、压缩审批时限
(十五)对药品批发企业经营第二类精神药品审批、经营医疗用毒性药品审批、经营第一类中的药品类易制毒化学品审批、经营蛋白同化制剂肽类激素审批等4个事项并入药品经营许可证变更事项,一次受理办结。
(十六)对执业药师注册等9个事项受理后即时办结;对化妆品生产许可证核发等13个事项,办理时限在法定时限内压缩50%以上;对药品生产许可证核发等26个事项,办理时限在法定时限内压缩30%以上;对放射性药品使用许可证核发等5个事项办理时限在法定时限内压缩20%以上。
七、优化办事流程
(十七)将药品GMP、GSP认证公示由“行政审查”后节点提前至“现场检查”后节点,统一公示期为10日,公示期与后续流程同步进行;将申请药品、医疗器械及化妆品生产许可证公示由“行政审查”后节点提前至“受理”后节点,统一公示期为7日,公示期与现场检查环节同步进行。
(十八)取消开办药品批发企业验收环节公示。
八、“容缺后补”审批
(十九)对省内企业间的兼并重组、出城入园、异地新建扩建,药品生产企业内部改变药品生产场地的药品补充申请,在确保药品安全有效、质量可控、审评审批标准不降低的前提下,可先一次性办理药品补充申请事项,再结合企业实际生产现状,进行品种的现场核查、抽样检验、技术审评,符合规定后允许上市销售。
九、优化审批服务
(二十)对采取撤销药品GSP、GMP认证证书措施的企业,在企业整改到位、监管部门查处到位且认为风险解除的,允许企业提前申请认证。
(二十一)进一步深化“一窗办、一网办、简化办、马上办”改革,增加“现场办、上门办”服务,在产业集中区设立药品检验检测技术服务机构,共享检验检测资源;根据地方政府和企业需求,上门提供政策咨询、技术指导和现场帮扶。
(二十二)对行政审批完成后制作的办件证书,根据申请人的意愿,提供免费快递送达服务。
十、全程在线服务
(二十三)省药品监管局承担的行政许可、备案事项全部依托甘肃政务服务网在线申报、全程一网通办,网上可办率100%。申请人可登陆行政审批系统,实时查看办理进度。2019年底前建成电子许可证应用平台,实现药品、医疗器械、化妆品行政审批在线颁发电子许可证。
附件:甘肃省药品监督管理局压缩审批时限一览表